Водородные топливные элементы – одна из наиболее горячо обсуждаемых тем в альтернативной энергетике. Тем не менее, переход к экономичному водороду несет с собой ряд сложностей, главная из которых – каким образом обеспечить массовое производство, транспортировку и хранение топливных элементов. Потому создатели источников энергообеспечения и обратили свой взгляд на спирты (этанол и метанол) как на более простые соединения.
Новый электрокатализатор может эффективно разлагать молекулы этанола, производя ионы водорода, электроны и диоксид углерода. Он был открыт в Брукхевенской национальной лаборатории Департамента энергетики и состоит из трех элементов: платины и родия, размещенных на нанослое оксида олова
![]()

Метаноловые батареи уже в предстоящие несколько лет готовы быть выведены на рынок малых элементов питания, но само вещество имеет ограниченное применение.

В связи с этим исследователи взялись за изучение свойств этанола, который постоянно падает в цене, благодаря простому получению из обычной целлюлозы — промышленное производство его давно налажено.
Главная сложность, однако, заключается в том, что связи между двумя атомами углерода в молекуле этилового спирта слишком прочны для того, чтобы быть разрушенными под воздействием большинства катализаторов, потому до недавнего времени считались тщетными. Но благодаря большому исследованию, проведенному учеными Департамента энергетики Брукхевенской национальной лаборатории совместно с исследователями университета Делавера (University of Delaware) и Ешива (Yeshiva University), решение было найдено.


Новый катализатор – сеть из платиновых и родиевых атомов, расположенных на связанных с углеродом наночастицах диоксида олова – способен разделить атомы углерода в молекуле спирта.
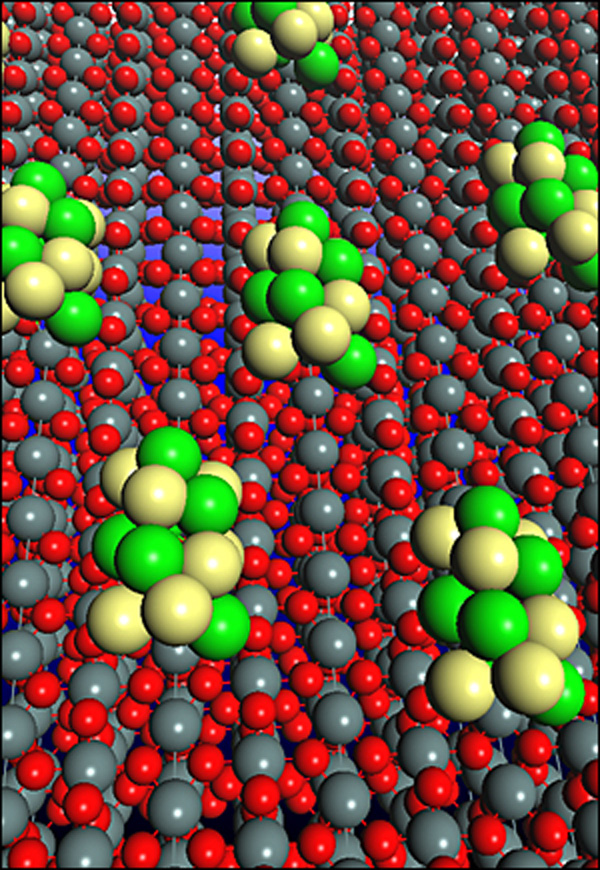
И даже больше: при комнатной температуре он может эффективно окислять получающиеся молекулы, приводя к образованию ионов водорода, электронов и диоксида углерода (в данном случае, побочного продукта). Испытываемые ранее катализаторы вызывали образование ацетальгида и уксусной кислоты – двух одноуглеродных молекул, которые, как и их предшественник, содержат атомы водорода, и потому эти реагенты не могут использоваться для генерации энергии.
Брукхевенский химик Радослав Аджич (Radoslav Adzic) утверждает: «Этанол – один из наиболее подходящих реагентов для топливных элементов.

Его легко произвести, он легко возобновляем, относительно легко транспортируем и имеет высокий энергетический потенциал». И добавляет: «Возможность разрыва углерод-углеродной связи и получения СО2 при комнатной температуре – абсолютно новое достижение катализа. Не существует других катализаторов, которые на практике показывают такие возможности».
С целью анализа поведения катализатора исследователи изучили данные рентгенологического абсорбционного исследования и трансмиссионной электронной микроскопии. Результатом стало лучшее понимание взаимодействия трех компонентов катализатора, вызывающее такую высокую химическую активность. Ученые верят, что полученные данные могут оказаться весьма полезными в других областях альтернативного энергообеспечения.
В ближайшее время планируется начать производство нового катализатора в количествах, достаточных для тестирования прототипов топливных элементов и коммерческого производства в дальнейшем. Созданная батарейка будет нуждаться в небольшом стимулирующем катализатор электрическом потенциале, но, как утверждают исследователи, этот потенциал очень мал, в отличие от требуемых другими, ранее открытыми.





